Keelektronegatifan merupakan ukuran seberapa kuat atom menarik electron ikatan ke diri mereka sendiri tentunya. Untuk simbolnya adalah huruf Yunani chi:x semakin tinggi elektronegativitas, semakin besar daya tarik atom untuk electron.
Keelektronegatifan adalah sifat dari atom yang meningkat dengan kecenderungannya untuk menarik elekyron dalam benyuk ikatan.
Kemudian jika atom yang terikat memiliki nilai ke elektronegatifan yang sama satu sama lain, mereka berbagi electron secara merata dalam ikatan kovalen.
Selanjutnya electron dalam ikatan kimia lebih tertarik pada satu atom (yang lebih elektronegatif) daripada yang lain. Ini menghasilkan ikatan kovalen polar tentunya.
Jika nilai keelektronegatifan sangat berbeda, elektron tidak akan dibagikan sama sekali. Satu atom pada dasarnya mengambil elektron ikatan dari atom lainnya, membentuk ikatan ion.
Nilai ke elektronegatifan pada skala Pauling adalah angka tanpa dimensi yang beroperasi dari sekitar 0,7 hingga 3,98.
Nilai skala Pauling relatif terhadap elektronegativitas hidrogen (2,20). Sementara skala Pauling paling sering digunakan, skala lainnya termasuk skala Mulliken, skala Allred-Rochow, skala Allen, dan skala Sanderson.
Elektronegativitas adalah sifat atom dalam molekul, dan bukan sifat inheren atom itu sendiri. Dengan demikian, keelektronegatifan sebenarnya bervariasi tergantung pada lingkungan atom tentunya.
#1. Keelektronegatifan Suatu Unsur Adalah Sifat Yang Menyatakan
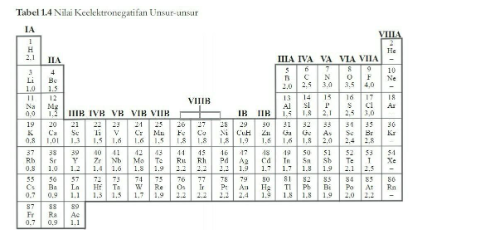
Ke elektronegatifan suatu unsur adalah sifat yang menyatakan merupakan system periodisitas unsur yang merupakan pengelompokkan unsur – unsur berdasarkan kemiripan sifat baik, baik sifat atom, maupun sifat senyawa.
Kemudian unsur – unsur kimia yang terdapat di dunia memiliki sifat sifat yang khas. Sifat – sifat tersebut ternyata memiliki keteraturan yang disusun dalam suatu table periodik
Nah demikianlah artikel ini tentang keelektronegatifan, semoga artikel ini dapat membantu anda dan saya ucapkan terimakasih.